Углекислый газ, свойства, получение и применение
Содержание:
- Что за соединения: CO, CO2, NOx?
- Свойства
- Углекислый газ и мы: чем опасен CO2
- Хранение и транспортировка углекислого газа
- Свойства углекислого газа
- Углекислый газ: получение в промышленности
- Применение
- Влияние углекислого газа на организм человека
- Плотность и другие свойства углекислого газа CO2 в зависимости от температуры и давления
- Решение задач по фазовым переходам
- Углекислый газ, формула, молекула, строение, состав, вещество:
- Сравнительная таблица
- Оксиды углерода
- История открытия углекислого газа
Что за соединения: CO, CO2, NOx?
Я даже почти разобралась с двумя первыми, вроде как окись углерода и двуокись углерода — но точное ли это название? В третьем скорее всего вместо х могут стоять разные циферки, но название будет общее?
Помогите, надо очень-очень срочно.
СО — оксид углерода(II), окись углерода (устаревшее название), угарный газ (бытовое название).
СО2 — оксид углерода(IV), диоксид углерода, двуокись углерода, угольный ангидрид, ангидрид угольной кислоты, углекислый газ.
NOx — общее название оксидов азота в химии атмосферы, включая выбросы двигателей внутреннего сгорания, разных топок — везде, где при высокой температуре реагируют кислород и азот воздуха. Это только два газа NO и NO2 (остальные оксиды азота не образуются). NO на воздухе окисляется до NO2. Оксиды азота и сами вредны, и способствуют образованию смога, и в атмосфере могут давать пероксиацетилнитрат (ПАН), вызывающий паралич сердца. К счастью, высокие его концентрации исключительно редки.
Если элемент имеет несколько валентностей, или он может иметь различную степень окисления, то возможно образование нескольких соединений с кислородом.
1.Углерод может иметь степень окисления в соединениях с кислородом (2+, 4+) или валентность II и IV, поэтому существует
- окись углерода СО, или оксид углерода (II);
- двуокись углерода СО2, или оксид углерода (IV).
2.Азот может иметь валентность или степень окисления в соединениях с кислородом: 1+, 2+, 3+, 4+, 5+ всегда с плюсом ( отдает электроны), поэтому он может иметь несколько оксидов:
- N20 — закись азота, или оксид азота (I);
- NO — окись азота, или оксид азота (II),
- N2O3 — окись азота, или оксид азота (III),
- NO2 — двуокись азота, или оксид азота (IV),
- N2O5 — пятиокись азота, или оксид азота (V).
Порой в химии некоторые соединения вызывают серьёзные затруднения, поскольку одна и та же химическая формула может иметь несколько названий.
Ниже предлагаю ознакомиться с тремя формулами CO, CO2, NOx, а также с их кратким описанием.



СО — окись или оксид углерода, соединение СО2 — углекислый газ, NO — нитрат, NO2 — нитрит, а вот у нитридов не помну сколько молекул кислорода.
Окись углерода, химическая формула — СО, это бесцветный газ без запаха и вкуса, но очень токсичный. Он является продуктом неполного сгорания углеродсодержащих соединений.
Диоксиид углероода или двуоокись углерода СО2 — присутствует в атмосфере в количестве примерно 385 частей на миллион (по объему) или 0,039%. 50 лет назад эта пропорция была гораздо меньше и составляла 280 частей на миллион.
NOx — оксиды азота, это семейство ядовитых, химически активных газов, которые образуются при сгорании топлива. NOx — побочный продукт работы почти всех транспортных средств (автомобили, строительная техника, лодки), а также промышленных предприятий: электростанций, различных печей, турбин и т.п. NOx является сильным окислителем, вступает в контакт с летучими органическими соединениями.
Свойства
Физические
Плотность при нормальных условиях 1,98 г/л. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Углекислый газ и мы: чем опасен CO2
Углекислый газ — один из продуктов обмена веществ в организме человека. Он играет большую роль в управлении дыханием и снабжением кровью органов. Рост содержания CO2 в крови вызывает расширение сосудов, способных таким образом транспортировать больше кислорода к тканям и органам. Аналогично и система дыхания понуждается к большей активности, если концентрация углекислоты в организме растет. Это свойство используют в аппаратах искусственной вентиляции легких, чтобы подстегнуть собственные органы дыхания пациента к большей активности.
https://youtube.com/watch?v=DqbvEhn5uJc
Кроме упомянутой пользы, превышение концентрации СO2 может принести организму и вред. Повышенное содержание во вдыхаемом воздухе приводит к тошноте, головной боли, удушью и даже к потере сознания. Организм протестует против углекислого газа и подает человеку сигналы. При дальнейшем увеличении концентрации развивается кислородное голодание, или гипоксия. Co2 мешает кислороду присоединяться к молекулам гемоглобина, которые и осуществляют перемещение связанных газов по кровеносной системе. Кислородное голодание ведет к снижению работоспособности, ослаблению реакции и способностей к анализу ситуации и принятию решений, апатии и может привести к смерти.

Общие симптомы отравления углекислым газом
Такие концентрации углекислого газа, к сожалению, достижимы не только в тесных шахтах, но и в плохо проветриваемых школьных классах, концертных залах, офисных помещениях и транспортных средствах — везде, где в замкнутом пространстве без достаточного воздухообмена с окружающей средой скапливается большое количество людей.
Хранение и транспортировка углекислого газа
Углекислый газ поставляется по ГОСТ 8050. Для получения качественных швов используют газообразную и сжиженную двуокись углерода высшего и первого сортов.
Углекислоту транспортируют и хранят в стальных баллонах по ГОСТ 949 или цистернах большой емкости в жидком состоянии с последующей газификацией на заводе, с централизованным снабжением сварочных постов через рампы.
В верхней части баллона вместе с газообразной углекислотой скапливается воздух. Вода, как более тяжелая, чем жидкая двуокись углерода, собирается в нижней части баллона.
Для снижения влажности углекислого газа рекомендуется установить баллон вентилем вниз и после отстаивания в течение 10…15 мин осторожно открыть вентиль и выпустить из баллона влагу. Перед сваркой необходимо из нормально установленного баллона выпустить небольшое количество газа, чтобы удалить попавший в баллон воздух
Часть влаги задерживается в углекислоте в виде водяных паров, ухудшая при сварке качество шва.
При выпуске газа из баллона вследствие эффекта дросселирования и поглощения теплоты при испарении жидкой двуокиси углерода газ значительно охлаждается. При интенсивном отборе газа возможна закупорка редуктора замерзшей влагой, содержащейся в углекислоте, а также сухим льдом. Во избежание этого при отборе углекислого газа перед редуктором устанавливают подогреватель газа. Окончательное удаление влаги после редуктора производится специальным осушителем, наполненным стеклянной ватой и хлористым кальцием, силикогелием, медным купоросом или другими поглотителями влаги.
Баллон окрашен в черный цвет, с надписью желтыми буквами «УГЛЕКИСЛОТА».
Свойства углекислого газа
В 17 веке Жан-Батист Ван Гельмонт из Фландрии открыл углекислый газ и определил его формулу. Подробное исследование и описание было сделано столетие спустя шотландцем Джозефом Блэком. Он исследовал свойства углекислого газа и провел серию опытов, в которых доказал, что он выделяется при дыхании животных.
В состав молекулы вещества входит один атом углерода и два атома кислорода. Химическая формула углекислого газа записывается как CO 2
В нормальных условиях не обладает вкусом, цветом и запахом. Только вдыхая большое его количество, человек ощущает кислый привкус. Его дает угольная кислота, образующаяся в малых дозах при растворении углекислого газа в слюне. Эта особенность применяется для приготовления газированных напитков. Пузырьки в шампанском, просекко, пиве и лимонаде — это и есть углекислый газ, образовавшийся в результате естественных процессов брожения или добавленный в напиток искусственно.
Плотность углекислого газа больше плотности воздуха, поэтому при отсутствии вентиляции он скапливается внизу. Он не поддерживает окислительные процессы, такие, как дыхание и горение.
Поэтому углекислоту применяют в огнетушителях. Это свойство углекислого газа иллюстрируют с помощью фокуса — горящую свечу опускают в «пустой» стакан, где она и гаснет. В действительности стакан заполнен CO 2 .
Углекислый газ: получение в промышленности

Существует большое количество способов промышленного получения углекислоты. Наиболее рентабельными являются варианты добычи газа, основанные на получении СО2, который образовывается на химических производствах в виде отходов.
Газообразный оксид углерода (IV) получают из промышленного дыма способом адсорбции моноэтаноламина. Частицы этого вещества подаются в трубу с отходами и вбирают в себя углекислоту. После прохождение через смесь CO2 моноэтаноламины направляются на очистку в специальные резервуары, в которых, при определённых показателях температуры и давления, происходит высвобождение углекислого газа.
Углекислый газ высокого качества получается в результате брожения сырья при изготовлении спиртных напитков. На таких производствах газообразный СО2 обрабатывают водородом, перманганатом калия и углем. В результате реакции получают жидкую форму углекислоты.
Твёрдое состояние СО2 или «сухой лёд» также получают из отходов пивоваренных заводов и ликероводочных производств. Это агрегатное состояние вещества в промышленных масштабах образуется в такой последовательности:
- Из резервуара, где происходит брожение, газ подаётся в ёмкость для промывки.
- Углекислота направляется в газгольдер, в котором подвергается воздействию повышенного давления.
- В специальных холодильниках СО2 охлаждается до определённой температуры.
- Образовавшаяся жидкость фильтруется через слой угля.
- Углекислота снова направляется в холодильник, где производится дополнительное охлаждение вещества с последующим прессованием.
Таким образом получается высококачественный «сухой лёд», который может использоваться в пищевой промышленности, растениеводстве или в быту.
Применение
Пищевая добавка Е290 применяется в производстве газированных напитков, в составе разрыхлителя для теста, выпечки и кондитерских изделий, при заморозке свежих продуктов, мороженного.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений.
Углекислый газ используется для газирования лимонада и газированной воды. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см2). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см2), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Польза и вред
Е290 считается нетоксичным (4 класс опасности ГОСТ 12.1.007), но при вдыхании диоксида углерода в повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам.
Незначительные повышения концентрации, вплоть до 2–4 %, в помещениях приводят к развитию у людей сонливости и слабости. Опасными для здоровья концентрациями считаются концентрации около 7–10 %, при которых развиваются симптомы удушья, проявляющиеся в виде головной боли, головокружения, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), эти симптомы развиваются, в зависимости от концентрации, в течение времени от нескольких минут до одного часа.
При вдыхании воздуха с очень высокими концентрациями газа смерть наступает очень быстро от удушья, вызванного гипоксией.
Несмотря на то, что даже концентрация 5–7 % CO₂ в воздухе несмертельна, но при концентрации 0,1 % (такое содержание углекислого газа иногда наблюдается в воздухе мегаполисов), люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоком уровне кислорода, большая концентрация CO2 существенно влияет на самочувствие человека.
Влияние углекислого газа на организм человека
Оксиды углерода с кислотностью +4 относятся к разделу удушающих газов. Иными словами, углекислый газ не является токсичным веществом, однако может существенно влиять на приток кислорода к организму. При повышении уровня углекислого газа до 3-4% у человека возникает серьезная слабость, его начинает клонить в сон. При повышении уровня до 10% начинают развиваться сильнейшие головные боли, головокружение, ухудшение слуха, иногда наблюдается потеря сознания. Если концентрация углекислого газа поднимается до уровня 20%, то наступает смерть от кислородного голодания.
Лечение отравления углекислым газом очень простое – дать жертве доступ к чистому воздуху, при необходимости сделать искусственное дыхание. В крайнем случае нужно подключить пострадавшего к аппарату искусственной вентиляции легких.
Из описаний влияния двух данных оксидов углерода на организм мы можем сделать вывод, что большую опасность для человека все же представляет угарный газ с его высокой токсичностью и направленным воздействием на организм изнутри.
Углекислый газ не отличается таким коварством и менее вреден для человека, поэтому именно это вещество человек активно применяет даже в пищевой промышленности.
Плотность и другие свойства углекислого газа CO2 в зависимости от температуры и давления
В таблице представлены теплофизические свойства углекислого газа CO2 в зависимости от температуры и давления. Свойства в таблице указаны при температуре от 273 до 1273 К и давлении от 1 до 100 атм.
Рассмотрим такое важное свойство углекислого газа, как плотность.Плотность углекислого газа равна 1,913 кг/м3 при нормальных условиях (при н.у.). По данным таблицы видно, что плотность углекислого газа существенно зависит от температуры и давления — при росте давления плотность CO2 значительно увеличивается, а при повышении температуры газа — снижается. Так, при нагревании на 1000 градусов плотность углекислого газа уменьшается в 4,7 раза. Однако, при увеличении давления углекислого газа, его плотность начинает расти, причем значительно сильнее, чем снижается при нагреве
Например при давлении 10 атм. и температуре 0°С плотность углекислого газа вырастает уже до значения 20,46 кг/м3
Однако, при увеличении давления углекислого газа, его плотность начинает расти, причем значительно сильнее, чем снижается при нагреве. Например при давлении 10 атм. и температуре 0°С плотность углекислого газа вырастает уже до значения 20,46 кг/м3.
Необходимо отметить, что рост давления газа приводит к пропорциональному увеличению значения его плотности, то есть при 10 атм. удельный вес углекислого газа в 10 раз больше, чем при нормальном атмосферном давлении.
В таблице приведены следующие теплофизические свойства углекислого газа:
- плотность углекислого газа в кг/м3;
- удельная теплоемкость, кДж/(кг·град);
- теплопроводность, Вт/(м·град);
- динамическая вязкость, Па·с;
- температуропроводность, м2/с;
- кинематическая вязкость, м2/с;
- число Прандтля.
Примечание: будьте внимательны! Теплопроводность в таблице указана в степени 102. Не забудьте разделить на 100!
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
- Сначала нужно перевести массу в килограммы:
100 г = 0,1 кг
Берем формулу количества теплоты для нагревания вещества:
Q = cm(tконечная-tначальная)
Подставляем числа:
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
- Сначала нужно перевести массу в килограммы и удельную теплоту в Дж/кг:
2,5 т = 2500 кг
80 кДж/кг = 80000 Дж/кг
Берем формулу количества теплоты для плавления вещества:
Q = λm
Подставляем числа:
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Углекислый газ, формула, молекула, строение, состав, вещество:
Углекислый газ (диоксид углерода, двуокись углерода, углекислота, оксид углерода (IV), угольный ангидрид) – бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Углекислый газ – бинарное химическое соединение углерода и кислорода, имеющее формулу CO2.
Химическая формула углекислого газа CO2.
Строение молекулы углекислого газа, структурная формула углекислого газа:
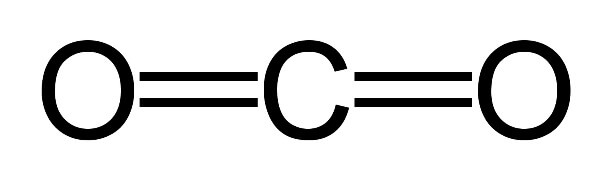
Углекислый газ тяжелее воздуха приблизительно в 1,5 раза. Его плотность при нормальных условиях составляет 1,98 кг/м3, по отношении к воздуху – 1,524. Поэтому скапливается в низких непроветриваемых местах.
Концентрация углекислого газа в воздухе (в атмосфере Земли) составляет в среднем 0,046 % (по массе) и 0,0314 % (по объему).
Углекислый газ вырабатывается в органах и тканях человека образуется в качестве одного из конечных продуктов метаболизма. Он переносится от тканей по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и содержание его мало в артериальной крови. В выдыхаемом человеком воздухе содержится около 4,5% диоксида углерода, что в 60-110 раз больше, чем во вдыхаемом. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
Углекислый газ растворяется в воде. В 100 граммах воды растворяется 0,3803 грамма CO2 при 16 °C, 0,3369 грамма CO2 – при 20 °C, 0,2515 грамма CO2 – при 30 °C. Растворяясь в воде, образует угольную кислоту Н2CO3. Растворим также в ацетоне, бензоле, метаноле и этаноле.
Термически устойчив при температурах менее 1000 °C. При температуре 1000 °C восстанавливается углем до оксида углерода (II).
При нормальном атмосферном давлении диоксид углерода не существует в жидком состоянии, существует только в твердом или газообразном состоянии. Твердая двуокись углерода при повышении температуры не плавится, а переходит (возгоняется) непосредственно из твёрдого состояния в газообразное. Твёрдую двуокись углерода также называют сухим льдом. Внешний вид сухого льда напоминает обычный лед, снегоподобную массу. При сублимации сухой лед поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
Под давлением 35 000 атм. твердая углекислота становится проводником электрического тока.
Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм.) газ сгущается в бесцветную жидкость. При нормальных условиях (20 °С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. Хранят и транспортируют углекислый газ, как правило, в жидком состоянии
Двуокись углерода негорюча, но в ее атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных – магния, кальция, бария.
Двуокись углерода нетоксична, невзрывоопасна.
Предельно допустимая концентрация двуокиси углерода в воздухе рабочей зоны не установлена, при оценке этой концентрации можно ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5% (об.) или 9,2 г/м (см. ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия»).
По степени воздействия на организм человека двуокись углерода относится к 4-му классу опасности по ГОСТ 12.1.007-76.
При концентрациях более 5% (92 г/м) двуокись углерода оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха в полтора раза и может накапливаться в слабопроветриваемых помещениях у пола и в приямках, а также во внутренних объемах оборудования для получения, хранения и транспортирования газообразной, жидкой и твердой двуокиси углерода. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Углекислый газ образуется при гниении и горении органических веществ, в результате вулканической деятельности. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Искусственными источниками образования углекислого газа являются промышленные выбросы и выхлопные газы автомобильного транспорта.
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего участвует в процессе глобального потепления.
Сравнительная таблица
Различие между твердыми материалами, жидкостями и газами объясняется внутренними процессами, зависящими от агрегатного состояния вещества. В таблице приведены характерные для каждого класса особенности.
| Состояние вещества | Расположение и характер движения частиц | Энергия взаимодействия | Физические свойства |
| Твердое | Расстояния между частицами, колеблющимися около положения равновесия, сопоставимы с их размерами. | Потенциальная энергия превышает кинетическую. Взаимодействие между частицами сильное. | Сохраняют собственную форму и объем. Имеют точную температуру кристаллизации и плавления. Обладают твердостью, прочностью и упругостью. |
| Жидкое | Частицы расположены вплотную и сохраняют близкий порядок упорядоченности. Могут перескакивать из одного положения равновесия в другой. | Модуль кинетической энергии почти равен потенциальной. | Сохраняют объем, но не форму. Закипают при определенной температуре. Текучи, почти не поддаются сжатию. |
| Газообразное | Частицы расположены хаотично на расстояниях, сильно превышающих их собственные размеры. Хаотичное движение частиц с довольно большими скоростями приводит к постоянным столкновениям между ними. | Кинетическая энергия по модулю намного превышает потенциальную. Легко заполняют весь предоставленный объем и сжимаются. | Принимают форму тех предметов, в которых находятся. |
Оксиды углерода
Ключевые слова конспекта: оксиды углерода, угарный газ, монооксид углерода, формиаты, газообразное топливо, газогенераторы, генераторный газ, углекислый газ, диоксид углерода,
Углерод образует два устойчивых оксида – оксид углерода (II) СО (монооксид углерода) и оксид углерода (IV) СO2 (диоксид углерода).
Оксид углерода (II) — угарный газ
Оксид углерода (II) (монооксид углерода, угарный газ СО) – вещество молекулярного строения. В молекуле СО связь ковалентная полярная, тройная. Две общие электронные пары образованы по обменному механизму, одна – по донорно-акцепторному: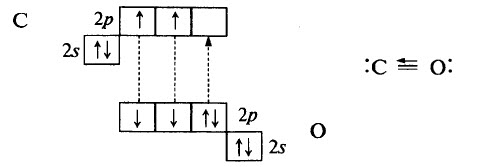
Тройная связь в молекуле СО очень прочная, её энергия больше, чем в молекуле N2 (1069 кДж/моль в молекуле СО, 946 кДж/моль в молекуле N2).
При обычных условиях оксид углерода (II) – газ без цвета, без запаха, чуть легче воздуха, плохо растворяется в воде и с ней не взаимодействует, сжижается при –191,5 °С, затвердевает при –205 °С.
Оксид углерода (II) – несолеобразующий оксид, при обычных условиях не взаимодействует ни с кислотами, ни со щелочами, но при нагревании под давлением реакция со щёлочью становится возможной, продуктами реакции являются формиаты – соли муравьиной кислоты: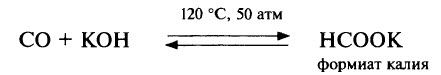
Оксид углерода (II) обладает ярко выраженными восстановительными свойствами за счёт углерода в промежуточной степени окисления +2. Восстановительные свойства оксида углерода (II) в обычных условиях выражены сильнее, чем у водорода. При нагревании он восстанавливает некоторые металлы из их оксидов:
На этом основана, например, выплавка чугуна из железных руд в домне.
Оксид углерода (II) горит в кислороде и образует с ним взрывчатые смеси (воспламенение происходит только при t° = 700 °С):
2СО + O2 = 2СO2
Оксид углерода (II) в лаборатории получают при нагревании смеси муравьиной кислоты и серной концентрированной. Серная кислота выступает в роли водоотнимающего (дегидратирующего) реагента:
Оксид углерода (II) имеет большое значение как составная часть газообразного топлива – воздушного, водяного или смешанного газа. Воздушный газ получают продуванием воздуха через раскалённый уголь в специальных цилиндрических печах – газогенераторах. Сверху в генератор загружают уголь, а снизу подают воздух. При горении угля в нижней зоне происходит полное окисление углерода:
С + O2 = СO2
Образующийся в нижней части генератора углекислый газ поднимается вверх и, проходя через раскалённые слои угля, взаимодействует с ним: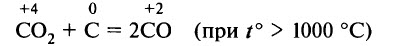
Образующийся оксид углерода (II) вместе с азотом воздуха выходит из генератора. Смесь этих газов в соотношении 1 : 2 (по объёму) называют генераторным газом.
Водяной газ получают путём пропускания водяных паров через раскалённый уголь (t° = 800– 1000 °С):
Оксид углерода (II) крайне токсичен, он связывается с гемоглобином крови, образуя очень прочный комплекс карбоксигемоглобина. Такой гемоглобин уже не может переносить кислород.
Оксид углерода (IV) — углекислый газ
Оксид углерода (IV) (диоксид углерода, углекислый газ СO2) – вещество молекулярного строения. В молекуле СO2 связи ковалентные полярные, двойные:
При обычных условиях оксид углерода (IV) – газ без цвета, без запаха, значительно тяжелее воздуха, растворим в воде. Твёрдый СO2 при t°= –78 °С возгоняется без плавления.
Оксид углерода (IV) – кислотный оксид, но только небольшая часть растворённого СO2 (менее 1%) взаимодействует с водой с образованием угольной кислоты:
СO2 + H2O ⇆ H2CO3
Оксид углерода (IV) взаимодействует со щелочами: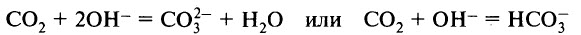
Оксид углерода (IV) взаимодействует с оксидами щелочных и щёлочноземельных металлов и магния:
MgO + СO2 = MgCO3
Качественной реакцией на углекислый газ является помутнение известковой воды – раствора гидроксида кальция:
Са(ОН)2 + СO2 = СаСO3↓ + H2O
При пропускании избытка углекислого газа помутнение исчезает:
СаСО3 + СO2 + H2O = Са(НСО3)2
В оксиде углерода (IV) содержится углерод в высшей степени окисления, следовательно, он может выступать в роли окислителя. Однако окислительные свойства для оксида углерода (IV) не характерны. Например, горящий магний продолжает гореть в углекислом газе:
В лаборатории оксид углерода (IV) получают взаимодействием карбонатов с сильными кислотами. Чаще всего кусочки мрамора СаСО3 обрабатывают соляной кислотой:
Конспект урока по химии «Оксиды углерода». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Ещё конспекты по теме «Углерод и кремний«:
История открытия углекислого газа
Углекислый газ – это первый газ, который был описан как дискретное вещество. В семнадцатом веке, фламандский химик Ян Баптист ван Гельмонт (Jan Baptist van Helmont) заметил, что после сжигания угля в закрытом сосуде масса пепла была намного меньше массы сжигаемого угля. Он объяснял это тем, что уголь трансформируется в невидимую массу, которую он назвал «газ».
Свойства углекислого газа были изучены намного позже в 1750г. шотландским физиком Джозефом Блэком (Joseph Black).
Он обнаружил, что известняк (карбонат кальция CaCO3) при нагреве или взаимодействии с кислотами, выделяет газ, который он назвал «связанный воздух». Оказалось, что «связанный воздух» плотнее воздуха и не поддерживает горение.
CaCO3 + 2HCl = СО2 + CaCl2 + H2O
Пропуская «связанный воздух» т.е. углекислый газ CO2 через водный раствор извести Ca(OH)2 на дно осаждается карбонат кальция CaCO3.
CaO + H2O = Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 + H2O