Бензойная кислота техническая. технические условия (с изменениями n 1, 2, 3, 4) гост 6413-77
Содержание:
- Индивидуальные доказательства
- Реакции замещения
- Использует [ редактировать ]
- Соли бензойной кислоты
- Структурная изомерия
- Химические свойства карбоновых кислот
- Производство [ править ]
- Действие на вредные организмы
- Средства для волос
- Laboratory preparations
- Влияние кислот на кожу
- Общая характеристика Benzoic acid
- Применение
Индивидуальные доказательства
- ↑ запись на в базе данных GESTIS вещества в IFA , доступ к 1 февраля 2016 года. (Требуется JavaScript)
- Лист данных по (PDF) от Merck , по состоянию на 28 декабря 2010 г.
- Чарльз Э. Мортимер: Химия — базовые знания химии , Thieme 2003, ISBN 3-13-484308-0 .
- ↑ Запись о В: Römpp Online . Георг Тиме Верлаг, по состоянию на 11 декабря 2011 г.
- Дэвид Р. Лид (Ред.): Справочник по химии и физике CRC . 90-е издание. (Интернет-версия: 2010 г.), CRC Press / Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, pp. 3-38.
- Кристиан Виганд: Происхождение и интерпретация важных органических тривиальных имен. В: Angewandte Chemie. А / 60. Родился в 1948 г. 4-й
- Клаус Д. Кристоф, Ренате Хаасс: Weihrauch: аромат небес. JH Röll Verlag, 2006, ISBN 978-3-89754-252-5 , стр. 49-50.
- Запись о В: Römpp Online . Георг Тиме Верлаг, доступ 9 февраля 2012 г.
Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:

Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:

|
Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду.
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |


Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.

| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:

2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:

| Серная кислота способствует образованию электрофила NO2+: |

Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:

либо п-нитротолуол:

Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):

2.3. Алкилирование ароматических углеводородов
Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |

Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |

| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |

Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |

2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:

Использует [ редактировать ]
Бензойная кислота в основном расходуется при производстве фенола путем окислительного декарбоксилирования при 300-400 ° C:
- C 6 H 5 CO 2 H + 12О 2 → С 6 Н 5 ОН + СО 2
Требуемая температура может быть снижена до 200 ° C путем добавления каталитических количеств солей меди (II). Фенол можно превратить в циклогексанол , который является исходным материалом для синтеза нейлона .
Прекурсор пластификаторов править
Бензоат пластификаторы , такие как гликолевых, diethyleneglycol- и триэтиленгликоль, сложные эфиры получают путем переэтерификации из метилового эфира бензойной кислоты с соответствующим диолом . Альтернативно эти частицы возникают при обработке бензоилхлорида диолом. Эти пластификаторы используются аналогично пластификаторам, полученным из эфира терефталевой кислоты .
Прекурсор бензоата натрия и связанных с ним консервантов править
Бензойная кислота и ее соли используются в качестве пищевых консервантов , представленных номерами E E210 , E211 , E212 и E213 . Бензойная кислота подавляет рост плесени , дрожжей и некоторых бактерий . Его либо добавляют напрямую, либо создают в результате реакций с его натриевой , калиевой или кальциевой солью. Механизм начинается с поглощения бензойной кислоты клеткой. Если внутриклеточный рН изменяется до 5 или ниже, анаэробной ферментации из глюкозы черезфосфофруктокиназа снижается на 95%. Таким образом, эффективность бензойной кислоты и бензоата зависит от pH пищи. Кислые продукты и напитки, такие как фруктовый сок ( лимонная кислота ), газированные напитки ( углекислый газ ), безалкогольные напитки ( фосфорная кислота ), соленые огурцы ( уксус ) или другие подкисленные продукты, консервируются бензойной кислотой и бензоатами.
Типичные уровни использования бензойной кислоты в качестве консерванта в пищевых продуктах составляют от 0,05 до 0,1%. Пищевые продукты, в которых может использоваться бензойная кислота, и максимальные уровни для ее применения регулируются местными законами о пищевых продуктах.
Высказывались опасения, что бензойная кислота и ее соли могут вступать в реакцию с аскорбиновой кислотой (витамином С) в некоторых безалкогольных напитках, образуя небольшие количества канцерогенного бензола .
Лекарственное править
Бензойная кислота входит в состав мази Whitfield в которую используют для лечения грибковых заболеваний кожи , таких как лишай , стригущий лишай и ноги спортсмена . Как основной компонент бензоина камеди , бензойная кислота также является основным ингредиентом как настойки бензоина, так и бальзама Фрайара. Такие продукты давно используются в качестве местных антисептиков и ингаляционных деконгестантов .
Бензойная кислота использовалась как отхаркивающее , болеутоляющее и антисептическое средство в начале 20 века.
Лабораторные исследования а также недавняя теоретическая работа показали, что производные бензойной кислоты являются многообещающими для подавления коронавируса ( SARS-CoV ).
Бензоилхлорид править
Бензойная кислота является предшественником бензоилхлорида C 6 H 5 C (O) Cl путем обработки тионилхлоридом , фосгеном или одним из хлоридов фосфора . Бензоилхлорид является важным исходным материалом для нескольких производных бензойной кислоты, таких как бензилбензоат , который используется в искусственных ароматизаторах и репеллентах от насекомых .
Соли бензойной кислоты
Рассмотрим какие бывают бензоаты, их свойства и применение:
- Бензоат аммония. Представляет собой неорганическое соединение бензойной кислоты и соли аммония. Не имеет цвета, хорошо растворяется в этаноле, воде. Структурная формула – NH4(C6H5COO). Используется как антисептик (предупреждает процессы разложения на поверхности открытых ран), консервант в пищевой промышленности для увеличения срока годности продуктов, стабилизатора при изготовлении клеев, латексов и ингибитора коррозии.
- Бензоат лития. Это белая кристаллическая соль лития и бензойной кислоты. Химическая формула соединения – C6H5 – COOLi. Имеет сладковатый вкус, без запаха, растворяется в воде. Используется в фармакологии как нормотимическое средство для нормализации психического состояния. Оказывает антиманиакальное, седативное, антидепрессивное действие. Данный эффект обусловлен тем, что ионы лития вытесняют из клеток ионы натрия, снижая биоэлектрическую активность нейронов мозга. В результате падает уровень серотонина в тканях, концентрация норэпинефрина, повышается чувствительность нейронов гиппокампа к действию допамина. В терапевтических концентрациях снижает концентрацию нейронального инозита и блокирует активность инозил –1–фосфатазы.
- Бензоат натрия. Выступает пищевой добавкой, зафиксирована под кодом Е211, относится к группе консервантов. Структурная формула – C6H5COONa. Натриевая соль бензойной кислоты имеет характерный неярко выраженный запах бензальдегида, белый цвет. Консервант угнетает рост плесневых грибов, включая афлатоксинобразующие, дрожжей и снижает активность ферментов, расщепляющих крахмал, триглицериды.
Лучшие материалы месяца
- Коронавирусы: SARS-CoV-2 (COVID-19)
- Антибиотики для профилактики и лечения COVID-19: на сколько эффективны
- Самые распространенные «офисные» болезни
- Убивает ли водка коронавирус
- Как остаться живым на наших дорогах?
В натуральных продуктах бензоат натрия содержится в яблоках, горчице, изюме, клюкве, корице. Применяется для консервирования плодово-ягодных, рыбных, мясных изделий, сладких газированных напитков. Входит в состав отхаркивающих средств, косметической продукции.
Помните, бензоат натрия может нарушать область ДНК в митохондриях и вызывать нейродегенеративные заболевания, болезнь Паркинсона, цирроз печени. Поэтому применение добавки Е211, из-за небезопасности для здоровья человека, в последние годы стремительно сокращается.
Таким образом, бензойная кислота и ее соли – органические добавки, используемые в пищевой, фармакологической, авиационной промышленностях и косметологии в качестве консерванта. Для сохранения здоровья употреблять продукты, содержащие Е210, нужно строго в умеренном количестве. Безопасная доза составляет 5 мг вещества на килограмм веса. Иначе перенасыщение организма бензойной кислотой может вызвать аллергические реакции, поражение нервной системы.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Автор статьи:
Тедеева Мадина Елкановна
Специальность: терапевт, врач-рентгенолог, диетолог.
Общий стаж: 20 лет.
Место работы: ООО “СЛ Медикал Груп” г. Майкоп.
Образование: 1990-1996, Северо-Осетинская государственная медицинская академия.
Другие статьи автора
Будем признательны, если воспользуетесь кнопочками:
Структурная изомерия
Для предельных карбоновых кислот характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры – это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для карбоновых кислот, которые содержат не менее четырех атомов углерода.
| Например. Формуле С4Н8О2 соответствуют бутановая и 2-метилпропановая кислота |
| Бутановая (масляная) кислота | Изомасляная (2-метилпропановая) кислота |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Карбоновые кислоты изомерны сложным эфирам. Общая формула и спиртов, и простых эфиров — CnH2nО2.
| Например. Межклассовые изомеры с общей формулой С2Н4О2: уксусная кислота СН3–CОOH и метилформиат H–COOCH3 |
| Уксусная кислота | Метиловый эфир муравьиной кислоты |
| СН3–CОOH | HCOOCH3 |
Общую формулу СnH2nO2 могут также иметь многие другие полифункциональные соединения, например: альдегидоспирты, непредельные диолы, циклические простые диэфиры и т.п.
Химические свойства карбоновых кислот
.
Для карбоновых кислот характерны следующие свойства:
|
1. Кислотные свойства
| Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н. |
|
Карбоновые кислоты – кислоты средней силы.
В водном растворе карбоновые кислоты частично диссоциируют на ионы: R–COOH ⇆ R-COO– + H+ |
1.1. Взаимодействие с основаниями
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
| Например, уксусная кислота растворяет осадок гидроксида меди (II) |
| Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония |
CH3COOH + NH3 = CH3COONH4
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
| Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода. |

1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
| Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды. |

| Например, уксусная кислота реагирует с оксидом меди (II) |
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
| Например, уксусная кислота растворяет карбонат кальция |

| Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа |

Производство [ править ]
Промышленные препараты править
Бензойная кислота производятся коммерчески частичным окислением из толуола с кислородом . Процесс катализируется нафтенатами кобальта или марганца . В процессе используется большое количество материалов, и он идет с высоким выходом.
Первый промышленный процесс включал реакцию бензотрихлорида (трихлорметилбензола) с гидроксидом кальция в воде с использованием железа или солей железа в качестве катализатора . Полученный бензоат кальция превращается в бензойную кислоту с помощью соляной кислоты . Продукт содержит значительное количество производных хлорированной бензойной кислоты. По этой причине бензойная кислота для потребления человеком была получена сухой перегонкой бензоина камеди. Пищевая бензойная кислота теперь производится синтетическим путем.
Лабораторный синтез править
Бензойная кислота дешевая и легкодоступная, поэтому лабораторный синтез бензойной кислоты в основном практикуется из-за ее педагогической ценности. Это обычная подготовка к бакалавриату.
Бензойную кислоту можно очистить перекристаллизацией из воды из-за ее высокой растворимости в горячей воде и плохой растворимости в холодной воде. Избегание использования органических растворителей для перекристаллизации делает этот эксперимент особенно безопасным. Этот процесс обычно дает около 65%
Гидролизом править
Подобно другим нитрилам и амидам , бензонитрил и бензамид можно гидролизовать до бензойной кислоты или ее сопряженного основания в кислотных или основных условиях.
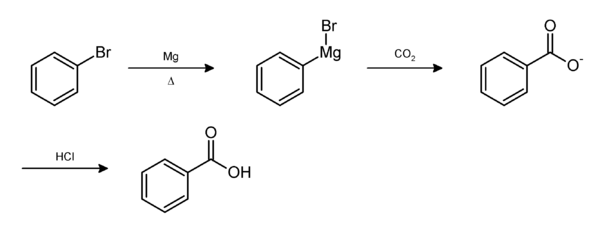
Из реактива Гриньяра править
Бромбензол можно превратить в бензойную кислоту «карбоксилированием» промежуточного фенилмагнийбромида
Этот синтез предлагает студентам удобное упражнение для проведения реакции Гриньяра , важного класса реакций образования углерод-углеродных связей в органической химии
Действие на вредные организмы
Бензойная кислота оказывает сильное угнетающее действие на плесневые грибы, бактерии и дрожжи, в частности, обладает значительным эффектом обеззараживания по слизеобразующим мезофиллам и плесневым грибам.
Помимо дезинфицирующих свойств, вещество тормозит физиологические процессы, в частности, интенсивность дыхания и прорастания урожая свеклы. За счет снижения интенсивности дыхания уменьшается количество проросших и загнивших корнеплодов свеклы. По данным из литературных источников, препарат Кагатник способствует уменьшению интенсивности дыхания на 12 мг СО2/г•ч (или на 24%).
Защитное действие препарата продолжается 90-120 дней.
Температурный оптимум Кагатника находится в диапазоне от 0 до 5 °С, т.е. полностью совпадает с наилучшей температурой для хранения корнеплодов свеклы. При ее повышении препарат полностью сохраняет свое антисептическое действие, поскольку отдельные углеводороды, входящие в его состав, переходят в газообразное состояние и действуют на микромицеты более активно. Однако из-за интенсивной диссоциации действующих веществ целесообразно повышение концентрации препарата при формировании кагата.
Механизм действия. Препарат «Кагатник» на основе бензойной кислоты имеет отличный от других фунгицидов механизм действия: он подавляет в клетках активность ферментов, которые расщепляют сахара, а также ферментов, отвечающих за окислительно-восстановительные реакции.
Как указывалось выше, карбоциклические углеводороды действуют не только на патогенную микрофлору, но и на корнеплоды, минимизируя интенсивность дыхания последних за счет интенсивной суберинизации поврежденных паренхимных тканей.
Средства для волос
Использование производителями benzoic acid в косметике для волос должно сопровождаться указанием мер предосторожности. Если при мытье головы шампунем на кожу попадает ничтожно малое количество Е210, то при создании прически вдыхается критическое ее количество с парами лака для волос

Аэрозольные смеси имеют маленькую каплю, вследствие чего долго находятся во взвешенном состоянии. Характерный запах парикмахерской во многом обусловлен средствами для укладки. При несоблюдении правил использования и количества лака, распыленного на волосы, раздражаются дыхательные пути, что при постоянном воздействии может привести к аллергической астме.
Laboratory preparations
Benzoic acid is cheap and readily available, so the laboratory synthesis of benzoic acid is mainly practiced for its pedogical value. It is a common undergraduate preparation and an unusual feature of the compound is that its melting point equals its molecular weight (122). For all syntheses, benzoic acid can be purified by recrystallization from water owing to its high solubility in hot and poor solubility in cold water. The avoidance of organic solvents for the recrystallization makes this experiment particularly safe.
By hydrolysis
Like any other nitrile or amide, benzonitrile and benzamide can be hydrolyzed to benzoic acid or its conjugate base in acid or basic conditions.
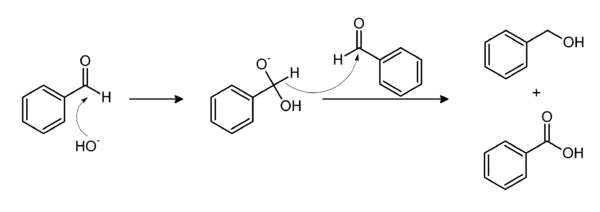
From benzaldehyde
The base-induced disproportionation of benzaldehyde, the Cannizzaro reaction, affords equal amounts of benzoate and benzyl alcohol; the latter can be removed by distillation.
From bromobenzene
Bromobenzene in diethyl ether is stirred with magnesium turnings to produce phenylmagnesium bromide (C6H5MgBr). This Grignard reagent is slowly added to dry ice (solid carbon dioxide) to give benzoate. Dilute acid is added to form benzoic acid.
From benzyl alcohol
Benzyl alcohol is refluxed with potassium permanganate or other oxidizing reagents in water. The mixture hot filtered to remove manganese oxide and then allowed to cool to afford benzoic acid.
Влияние кислот на кожу
Эти вещества обладают множеством полезных свойств. Прежде всего их используют для омоложения и очищения эпителия. При систематическом и правильном применении таких средств уже через 2 недели можно добиться целого ряда результатов:
- вывести из дермы избыток влаги – как следствие, удается уменьшить отечность;
- нормализовать кислотно-щелочной баланс в структуре дермы;
- наладить работу сальных желез;
- сделать кожу более нежной и эластичной;
- разгладить морщины и сделать их менее выраженными;
- справиться с высыпаниями и постакне;
- облегчить протекание кожных патологий и ускорить процесс выздоровления;
- осветлить пигментацию, сделать пятна менее заметными или полностью устранить их;
- очистить и сузить поры;
- уменьшить число черных точек;
- сократить вероятность появления злокачественных эпителиом;
- увлажнить эпителий;
- повысить сопротивляемость кожи внешним факторам – воздействию ультрафиолета, морозов, инфекций;
- укрепить сосуды;
- уменьшить шелушения;
- справиться со шрамами, растяжками, рубцами.
Хотя кислоты имеют обширную сферу применения, не стоит считать такие средства универсальными. Подобные вещества оказывают целенаправленное действие. Их можно применять в качестве омолаживающих средств для устранения морщин или использовать для купирования воспаления. Также вещества способствуют отбеливанию кожи, помогая справляться с пигментацией.

Чтобы добиться ощутимых результатов, нужно определить характер проблемы и подобрать оптимальный состав средства. Каждый из продуктов с содержанием кислот имеет специфические характеристики.
Общая характеристика Benzoic acid
Benzoic acid (Бензойд Эйсид — C7H6O2 (or C6H5COOH)) – это бензойная кислота, а так же её многочисленные эфиры, которые великолепно чувствуют себя в эфирных маслах, в бальзамах, производная от бензойной смолы.
Впервые бензойная кислота была получена в 16 столетии из росного ладана путем возгонки. Спустя 3 века ученый Юстус фон Либих смог выявить структуру бензойной кислоты. Тогда же, в 19 веке вместе с другими немецкими химиками ему удалось установить немало сходств между свойствами бензойной кислоты и гиппуровой кислоты. Уже в 20 столетии бензойную кислоту стали активно использовать как пищевой консервант при изготовлении различных продуктов питания. Основанием для этого стали некоторые полезные свойства кислота, а именно – противомикробное и противогрибковое.
В настоящее время Benzoic acid производится окислением толуола с использованием катализаторов. Несколько ранее ее получали из фталевой кислоты или бензотрихлорида, но от этого способа было решено отказаться в дороговизны, да и технологический процесс был слишком сложным. Кроме этого кислоту можно встретить в природе в некоторых ягодах, таких как клюква, малина или брусника, а также в чае, анисе, вишневом дереве и коре акакии.
Бензойная кислота представляет собой белое кристаллическое вещество. По своей форме она напоминает тонкие длинные листочки либо же иголочки, блестящие при попадании солнечных лучей либо света лампы. Она с легкостью растворяется в разных веществах, будь то обычная вода, жир или спирт. Кроме того, бензойная кислота имеет свойство расплавляться и переходить в газообразное состояние. Происходит это при температуре ее нагревания 122 градуса по Цельсию.
Бензоаты (эфиры и соли бензойной кислоты) активно используют в пищевой промышленности, как пищевые консерванты (например: Е-210, Е-211, Е-212, Е-213). Обусловлено это лёгкостью и легкодоступностью производства консерванта. Их основное преимущество – подавление роста некоторых видов грибков, дрожжей и бактерий. В рамках законодательства применение этой кислоты допустимо – 0,05 до 0,1 %. И не более.
Применение полезных свойств Benzoic acid
В косметике
Для косметических целей C7H6O2 производится, практически всегда, синтетическим путём. Основная роль добавки – консервант, подавление роста бактерий, увеличение срока годности товара. Но по международным стандартам производитель обязан указывать лишь 40% всех ингредиентов, входящих в состав вашей парфюмированой баночки в косметичке. И, скорее всего, о бензойной кислоте в составе вас предупредят, но довольно отдалённо – не указывая явного процентного соотношения.
Если говорить, в каких косметических средствах используется бензойная кислота, то первым делом нужно обратить внимание на крема, лосьоны и скрабы для проблемной кожи. Обладая свойством активной борьбы с микробами, кислота в составе этих косметических средств поможет избавиться от прыщей и покраснений на лице и на других частях тела
Также она применяется для отбеливания кожи, удаления пигментных пятен и веснушек.

В пищевой промышленности
В пищевой промышленности используется антимикробное свойство бензойной кислоты. Так увидеть ее можно в составе таких продуктов, как соусы, кетчуп, ягодные и овощные консервы, рыбные продукты, алкогольные и безалкогольные напитки.
В медицине
Бензойная кислота активно борется с грибком и различными микробами, поэтому ее часто используют в медицине при изготовлении препаратов для лечения грибка кожи и некоторых лишайных заболеваний.
Применение
По внешнему виду бензойная кислота – продолговатые кристаллы белого цвета, которые имеют характерный блеск. При температуре 122 градуса по Цельсию переходит в газообразное состояние. Бензойная кислота растворима в спиртах, воде, жирах. В промышленных масштабах производится путем окисления толуола. Помимо этого, вещество получают из фталевой кислоты.
Консервант используется в хлебопекарной, кондитерской, пивоваренной промышленностях для производства следующей продукции:
- фруктовых и овощных пюре;
- безалкогольных напитков;
- ягодных соков;
- рыбных продуктов;
- консервированных фруктов, оливок;
- мороженого;
- варенья, джема, повидла;
- овощной консервации;
- маргарина;
- жевательной резинки;
- конфет и сахарозаменителей;
- деликатесной икры;
- молочных изделий
- ликера, пива, вина.
Антисептические, антибактериальные способности бензойной кислоты используют в фармакологической промышленности для производства противогрибковых медикаментов, мазей от чесотки. А специальные ванночки для стоп с применением органического соединения избавляют от чрезмерной потливости, грибка ног. Помимо этого, бензойную кислоту добавляют в сиропы от кашля, поскольку она обладает отхаркивающим свойством и разжижает мокроту.
В качестве консервирующего вещества ее используют в косметике для сохранения полезных свойств и продления срока годности кремов, лосьонов, бальзамов. Благодаря сильным отбеливающим свойствам, соединение входит в состав масок, действие которых направлено на избавление лица от веснушек, неровностей на коже, пигментных пятен.

