Конвертация единиц измерения концентрации
Содержание:
- Таблица конвертации EC в TDS/ppm
- Связанные количества
- Eau de toilette
- Формулы для пересчета концентраций растворов
- Зависит ли ароматическая стойкость от концентрации
- ПРИЛОЖЕНИЕ 1 (обязательное)
- Как пользоваться EC- или TDS-метром?
- Eau (eu) de parfum: что это такое значит
- Получение объема раствора с молярной концентрацией эквивалента
- На заметку
- Растворы. Способы выражения концентрации
- Почему EC практичнее, чем TDS/ppm?
- Состав парфюмерии
- Вычисление массовой доли спиртов в смеси этанола и метанола
Таблица конвертации EC в TDS/ppm
| EC(mS/cm) | TDSАмериканский | TDSЕвропейский | TDSАвстралийский |
|---|---|---|---|
| EC 0.1 | 50 ppm | 64 ppm | 70 ppm |
| EC 0.2 | 100 ppm | 128 ppm | 140 ppm |
| EC 0.3 | 150 ppm | 192 ppm | 210 ppm |
| EC 0.4 | 200 ppm | 256 ppm | 280 ppm |
| EC 0.5 | 250 ppm | 320 ppm | 350 ppm |
| EC 0.6 | 300 ppm | 384 ppm | 420 ppm |
| EC 0.7 | 350 ppm | 448 ppm | 490 ppm |
| EC 0.8 | 400 ppm | 512 ppm | 560 ppm |
| EC 0.9 | 450 ppm | 576 ppm | 630 ppm |
| EC 1.0 | 500 ppm | 640 ppm | 700 ppm |
| EC 1.1 | 550 ppm | 704 ppm | 770 ppm |
| EC 1.2 | 600 ppm | 768 ppm | 840 ppm |
| EC 1.3 | 650 ppm | 832 ppm | 910 ppm |
| EC 1.4 | 700 ppm | 896 ppm | 980 ppm |
| EC 1.5 | 750 ppm | 960 ppm | 1050 ppm |
| EC 1.6 | 800 ppm | 1024 ppm | 1120 ppm |
| EC 1.7 | 850 ppm | 1088 ppm | 1190 ppm |
| EC 1.8 | 900 ppm | 1152 ppm | 1260 ppm |
| EC 1.9 | 950 ppm | 1216 ppm | 1330 ppm |
| EC 2.0 | 1000 ppm | 1280 ppm | 1400 ppm |
| EC 2.1 | 1050 ppm | 1334 ppm | 1470 ppm |
| EC 2.2 | 1100 ppm | 1408 ppm | 1540 ppm |
| EC 2.3 | 1150 ppm | 1472 ppm | 1610 ppm |
| EC 2.4 | 1200 ppm | 1536 ppm | 1680 ppm |
| EC 2.5 | 1250 ppm | 1600 ppm | 1750 ppm |
| EC 2.6 | 1300 ppm | 1664 ppm | 1820 ppm |
| EC 2.7 | 1350 ppm | 1728 ppm | 1890 ppm |
| EC 2.8 | 1400 ppm | 1792 ppm | 1960 ppm |
| EC 2.9 | 1450 ppm | 1856 ppm | 2030 ppm |
| EC 3.0 | 1500 ppm | 1920 ppm | 2100 ppm |
Связанные количества
Для описания состава смеси можно использовать несколько других величин
Обратите внимание, что это не следует называть концентрациями.
Нормальность
Нормальность определяется как молярная концентрация, деленная на коэффициент эквивалентности . Поскольку определение фактора эквивалентности зависит от контекста (какая реакция изучается), IUPAC и NIST не одобряют использование нормальности.
cя{\ displaystyle c_ {i}}жеq{\ displaystyle f _ {\ mathrm {eq}}}
Моляльность
(Не путать с молярностью )
Моляльность раствора определяется как количество составляющего (в молях), деленное на массу растворителя (а не на массу раствора):
бя{\ displaystyle b_ {i}}пя{\ displaystyle n_ {i}}мsолvепт{\ displaystyle m _ {\ mathrm {растворитель}}}
- бязнак равнопямsолvепт.{\ displaystyle b_ {i} = {\ frac {n_ {i}} {m _ {\ mathrm {растворитель}}}}.}
Единица СИ для моляльности является моль / кг.
Мольная доля
Мольная доля определяется как количество компонента (в молях), деленное на общее количество всех компонентов в смеси :
Икся{\ displaystyle x_ {i}}пя{\ displaystyle n_ {i}}птот{\ displaystyle n _ {\ mathrm {tot}}}
- Иксязнак равнопяптот.{\ displaystyle x_ {i} = {\ frac {n_ {i}} {n _ {\ mathrm {tot}}}}.}
Единица СИ является моль / моль. Однако устаревшее обозначение частей на единицу часто используется для описания малых мольных долей.
Молярное отношение
Молярное соотношение определяется как количество компонента, деленное на общее количество всех других компонентов в смеси:
ря{\ displaystyle r_ {i}}пя{\ displaystyle n_ {i}}
- рязнак равнопяптот-пя.{\ displaystyle r_ {i} = {\ frac {n_ {i}} {n _ {\ mathrm {tot}} -n_ {i}}}.}
Если намного меньше , мольное отношение почти идентично мольной доле.
пя{\ displaystyle n_ {i}}птот{\ displaystyle n _ {\ mathrm {tot}}}
Единица СИ является моль / моль. Однако устаревшее обозначение частей на единицу часто используется для описания малых мольных соотношений.
Массовая доля
Массовая доля — это отношение массы одного вещества к массе всей смеси , определяемое как:
шя{\ displaystyle w_ {i}}мя{\ displaystyle m_ {i}}мтот{\ Displaystyle м _ {\ mathrm {tot}}}
- шязнак равномямтот.{\ displaystyle w_ {i} = {\ frac {m_ {i}} {m _ {\ mathrm {tot}}}}.}
Единица СИ является кг / кг. Однако устаревшее обозначение частей на единицу часто используется для описания малых массовых долей.
Соотношение масс
Массовое отношение определяется как масса компонента, деленная на общую массу всех других компонентов в смеси:
ζя{\ displaystyle \ zeta _ {я}}мя{\ displaystyle m_ {i}}
- ζязнак равномямтот-мя.{\ displaystyle \ zeta _ {i} = {\ frac {m_ {i}} {m _ {\ mathrm {tot}} -m_ {i}}}.}
Если намного меньше , массовое отношение почти идентично массовой доле.
мя{\ displaystyle m_ {i}}мтот{\ Displaystyle м _ {\ mathrm {tot}}}
Единица СИ является кг / кг. Однако устаревшее обозначение частей на единицу часто используется для описания небольших массовых соотношений.
Eau de toilette

Сегодня EDT – один из самых популярных типов изделий. Покупателей больше всего привлекает относительно низкая цена. Нужно отметить, что это нестойкая продукция. Как правило, держится она в пределах трех часов. Ответ на вопрос: «Что это такое – Eau de toilette (EDT) в парфюмерии» дает его концентрация – она составляет не более 10%. Ей и определяется небольшая стойкость. Подобной водичкой можно душиться не один раз за сутки. Купив маленькую бутылочку и положив ее в сумочку, вы сможете пользоваться ею по мере необходимости. Благодаря своей ненасыщенности и легкости хорошо подходит даже в знойные летние дни.
Покупая данный вид парфюмерии, немногие из нас задумываются о его происхождении. А корни уходят далеко в античную Грецию и Египет, когда душистым раствором пользовались, чтобы наполнить помещение приятным благоуханием. Однако официальной версией создания данного продукта считается случай, когда Наполеона Бонапарта отправили в ссылку на остров St. Helena. Во время заточения у полководца Франции закончился одеколон. Тогда бывший император создал свою ароматную жидкость, главным компонентом которой был бергамот.
Формулы для пересчета концентраций растворов
В приводимой ниже таблице приняты следующие обозначения:
М — мольная масса растворенного вещества, г/моль; Э — эквивалентная масса растворенного вещества, г/моль; р — плотность раствора, г/мл.

* Дли жидкостей может применяться величина Pv, % (об.) —число миллилитров растворенной жидкости в 100 мл раствора.
РАСЧЕТНЫЕ ФОРМУЛЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРОВ
Для приготовления определенного количества раствора какого-либо вещества заданной концентрации исходят из следующих данных: а) из количества чистого вещества и растворителя; б) из количества раствора данного вещества с более высокой концентрацией, чем заданная, и количества чистого растворителя или в) из количества двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше.
Растворение вещества в воде
Пусть требуется приготовить А граммов раствора концентрации P . Тогда:
(I)
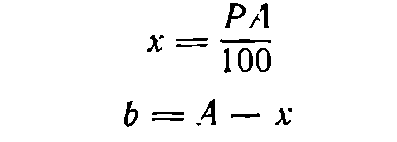
где х— необходимая масса растворяемого вещества, г; b—необходимая масса воды, г.
Если нужно приготовить определенный объем V раствора (в мл) концентрации Р, находят по таблицам плотность р (в г/см3) раствора данного вещества требуемой концентрации. Поскольку А = Vp, формула (1) будет иметь вид:
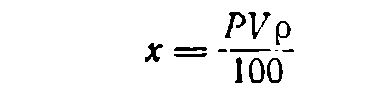
В тех случаях, когда растворяемое вещество представляет собой кристаллогидрат, т. е. содержит кристаллизационную воду, для расчета необходимого его количества используют формулу:
(4)
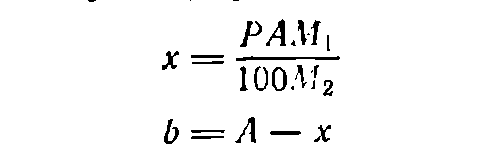
где х— необходимая масса кристаллогидрата, г; M1—мольная масса кристаллогидрата; М2—моль-мая масса вещества без кристаллизационной воды; b — необходимая масса воды, г.
Если нужно приготовить раствор объемом V (в мл) заданной нормальности N, вычисляют значение эквивалентной массы Э растворяемого вещества, после чего находят необходимую его навеску (в г) по формуле:
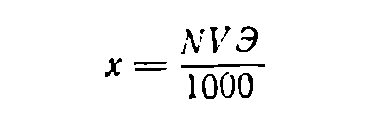
При приготовлении раствора заданной молярной концентрации применяют аналогичную формулу:
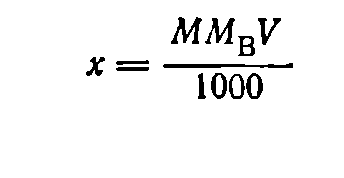
где М — молярная концентрация раствора; Мв — мольная масса растворяемого вещества; V — заданный объем раствора, мл.
Разбавление раствора водой
Пусть требуется приготовить раствор концентрации Р2 из имеющегося раствора с более высокой концентрацией Р1. Обозначим массу раствора до разбавления А1, а массу раствора после разбавления— А2. Тогда массу воды b (в г), необходимую для разбавления, находят по формуле (8) или (9) в зависимости от того, задано ли значение А\ или А2.
(9)
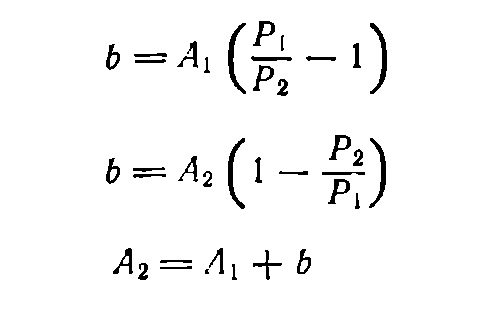
В тех случаях, когда известна не масса, а объем раствора, необходимо по таблицам найти плотности растворов данного вещества исходной и конечной концентраций — p1 и р2 соответственно. Тогда, если нужно приготовить раствор объемом V2 (в мл) концентрации Р2 , а концентрация исходного раствора равна P1 , то объем исходного раствора вычисляется по формуле:
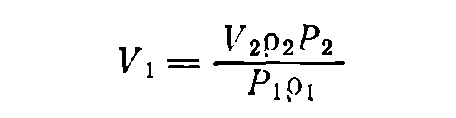
Объем воды (в мл) для разбавления: b = V2 — V1
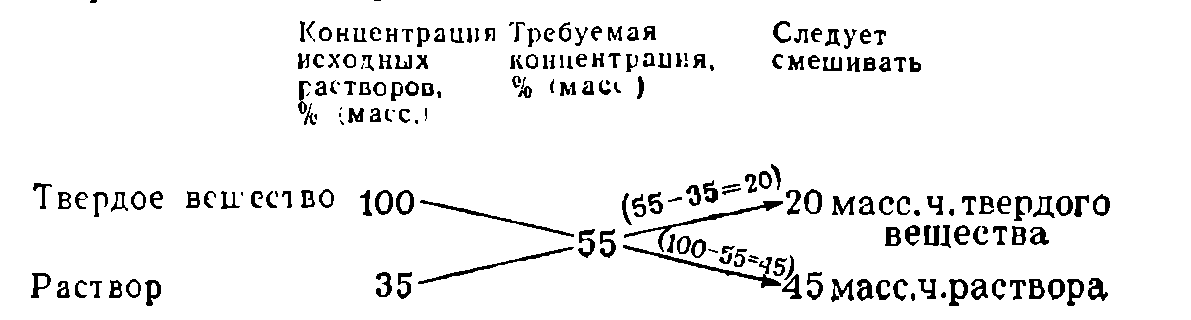
Смешивание двух растворов различной концентрации
Пусть требуется приготовить раствор заданной концентрации из двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше. Чтобы определить, в каких пропорциях следует смешивать растворы, пользуются «правилом креста», которое наглядно показано на следующем примере:
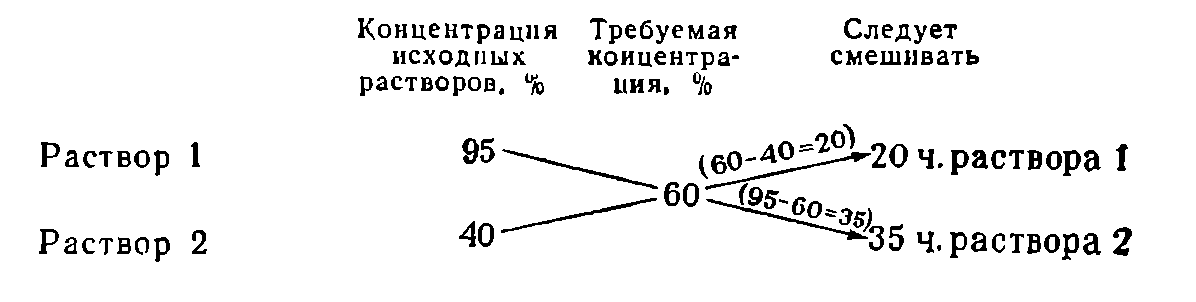
Смешиваемые растворы можно измерять в объемных или массовых частях в зависимости от того, в объемных или массовых процентах выражают концентрацию растворов.
«Правило креста» можно применять и в случаях разбавления раствора чистым растворителем. При этом концентрацию вещества в чистом растворителе считают равной нулю:

Для получения более концентрированного раствора растворением в нем дополнительного количества компонента твердое вещество условно считают раствором с концентрацией 100%:
Зависит ли ароматическая стойкость от концентрации
Этот показатель любого парфюмированного продукта обуславливается несколькими факторами. Чем выше концентрированность, тем дольше будет ощущаться вся композиция. Запах хороших концентрированных парфюма или духов держится до 8 ч. Кстати, согласно советским ГОСТам, устойчивость должна быть не менее 60 часов. Например, если взять оригинальную «Красную Москву» и нанести ее на хлопковую ткань, вы будете ощущать ее и через 2-3 дня. Но сегодня далеко не многие предпочитают покупать и уж тем более носить на себе.
На крепость удержания запаха влияет непосредственно его тип: слабый или сильный. Первый, как правило, используется днем, а второй – вечером, или же в дневной период, но для особых случаев. Конечно, последний более стойкий.
Все ароматы классифицируют на цветочные, цитрусовые и амбровые. Менее стойкими будут цитрусы, а самыми сильными – композиции с амброй.
Большую роль в парфюмерии играет качество и концентрация эфирных масел из состава парфюма или духов.
Тип кожного покрова также определяет, как долго будет ощущаться флер: дольше на увлажненной или слегка жирной коже и меньше на сухой.
Места нанесения – еще один немаловажный фактор. Чтобы благоухание держалось как можно дольше, наносить капельки парфюма нужно на участки, где кровеносные сосуды расположены максимально ближе к поверхности дермы: запястье, внутренняя часть локтя, за ухом, где ощущается пульсация и т.д. Также несколько капель нужно обязательно нанести на чистые волосы.
Купить хорошую парфюмерную продукцию вы можете в бутиках, супермаркетах или заказать онлайн. Помните, что указанная производителем стойкость будет гарантирована в том случае, если это оригинальный продукт, а не подделка. Когда вам сложно их отличать, лучше обращаться к надежным и проверенным магазинам и сайтам.
На AromaCODE вы сможете найти широкий выбор парфюмерии по доступным ценам. При необходимости наши специалисты проконсультируют вас по любому вопросу и помогут выбрать наиболее подходящий аромат, который не разочарует в своей стойкости.
ПРИЛОЖЕНИЕ 1 (обязательное)
ПРИЛОЖЕНИЕ 1ОбязательноеТаблица 1
Приведение объемов титрованных растворов при данной температуре к объемам при 20 °С (для 1000 см)
|
Температура, °C |
Вода, растворы молярной концентрации 0,01 моль/дм |
Растворы молярной концентрации |
||||
|
0,1 моль/дм (кроме ) |
0,5 моль/дм |
1 моль/дм |
0,5 моль/дм |
1 моль/дм |
||
|
5 |
+1,5 |
+1,7 |
+1,9 |
+2,3 |
+2,35 |
+3,6 |
|
6 |
+1,5 |
+1,65 |
+1,85 |
+2,2 |
+2,25 |
+3,4 |
|
7 |
+1,4 |
+1,6 |
+1,8 |
+2,15 |
+2,2 |
+3,2 |
|
8 |
+1,4 |
+1,55 |
+1,75 |
+2,1 |
+2,15 |
+3,0 |
|
9 |
+1,4 |
+1,5 |
+1,7 |
+2,0 |
+2,05 |
+2,7 |
|
10 |
+1,3 |
+1,45 |
+1,6 |
+1,9 |
+1,95 |
+2,5 |
|
11 |
+1,2 |
+1,35 |
+1,5 |
+1,8 |
+1,8 |
+2,3 |
|
12 |
+1,1 |
+1,3 |
+1,4 |
+1,6 |
+1,7 |
+2,0 |
|
13 |
+1,0 |
+1,1 |
+1,2 |
+1,4 |
+1,5 |
+1,8 |
|
14 |
+0,9 |
+1,0 |
+1,1 |
+1,2 |
+1,3 |
+1,6 |
|
15 |
+0,8 |
+0,9 |
+0,9 |
+1,0 |
+1,1 |
+1,3 |
|
16 |
+0,6 |
+0,7 |
+0,8 |
+0,8 |
+0,9 |
+1,1 |
|
17 |
+0,5 |
+0,6 |
+0,6 |
+0,6 |
+0,7 |
+0,8 |
|
18 |
+0,3 |
+0,4 |
+0,4 |
+0,4 |
+0,5 |
+0,6 |
|
19 |
+0,2 |
+0,2 |
+0,2 |
+0,2 |
+0,2 |
+0,3 |
|
20 |
0,0 |
0,0 |
0,0 |
0,0 |
0,0 |
0,0 |
|
21 |
-0,2 |
-0,2 |
-0,2 |
-0,2 |
-0,2 |
-0,3 |
|
22 |
-0,4 |
-0,4 |
-0,4 |
-0,5 |
-0,5 |
-0,6 |
|
23 |
-0,6 |
-0,6 |
-0,7 |
-0,7 |
-0,8 |
-0,9 |
|
24 |
-0,8 |
-0,9 |
-0,9 |
-1,0 |
-1,0 |
-1,2 |
|
25 |
-1,0 |
-1,1 |
-1,1 |
-1,2 |
-1,3 |
-1,5 |
|
26 |
-1,3 |
-1,4 |
-1,4 |
-1,4 |
-1,5 |
-1,8 |
|
27 |
-1,5 |
-1,7 |
-1,7 |
-1,7 |
-1,8 |
-2,1 |
|
28 |
-1,8 |
-2,0 |
-2,0 |
-2,0 |
-2,1 |
-2,4 |
|
29 |
-2,1 |
-2,3 |
-2,3 |
-2,3 |
-2,4 |
-2,8 |
|
30 |
-2,3 |
-2,5 |
-2,5 |
-2,6 |
-2,8 |
-3,2 |
Числа в графах 2-7 выражают объемы в кубических сантиметрах, которые следует прибавить (+) к 1000 см соответствующей жидкости при °С или вычесть (-) от 1000 см, чтобы получить объем титрованного раствора при 20 °С.Примеры
1. В колбу вместимостью 1 дм, калиброванную при 20 °C, необходимо налить при 15 °C раствор азотнокислого серебра 0,1 моль/дм. По табл.1 находим, что при 20 °C этот раствор займет объем больший на 0,9 см.
2. Из бюретки, калиброванной при 20 °С, при 25 °C израсходовано на титрование 34,75 см раствора гидроокиси натрия концентрации 1 моль/дм. При 20 °С расход реактива будет следующий:
см.
Таблица 2
Поправка объемов разбавленных растворов при разных температурах
|
Температура, °C |
Объем, см |
|||||
|
10 |
20 |
25 |
30 |
40 |
50 |
|
|
Поправка |
||||||
|
10 |
+0,01 |
+0,03 |
+0,03 |
+0,04 |
+0,05 |
+0,06 |
|
12 |
+0,01 |
+0,02 |
+0,03 |
+0,03 |
+0,04 |
+0,06 |
|
14 |
+0,01 |
+0,02 |
+0,02 |
+0,03 |
+0,04 |
+0,05 |
|
16 |
+0,01 |
+0,01 |
+0,02 |
+0,02 |
+0,03 |
+0,03 |
|
18 |
0,00 |
+0,01 |
+0,01 |
+0,01 |
+0,01 |
+0,02 |
|
20 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
|
22 |
0,00 |
-0,01 |
-0,01 |
-0,01 |
-0,02 |
-0,02 |
|
24 |
-0,01 |
-0,02 |
-0,02 |
-0,02 |
-0,03 |
-0,04 |
|
26 |
-0,01 |
-0,03 |
-0,03 |
-0,04 |
-0,05 |
-0,06 |
|
28 |
-0,02 |
-0,03 |
-0,04 |
-0,05 |
-0,07 |
-0,09 |
|
30 |
-0,02 |
-0,03 |
-0,05 |
-0,07 |
-0,09 |
-0,12 |
Табл.2 пользуются при работе с растворами концентрации 0,1 моль/дм или более разбавленными. ПРИЛОЖЕНИЕ 1. (Измененная редакция, Изм. N 1).
Как пользоваться EC- или TDS-метром?
Элементарно просто! Я ведь говорил, что эти приборы не сложнее градусника, правда? Сейчас вы в этом убедитесь.

• Снимите колпачок, защищающий электроды и погрузите их в раствор на глубину, не превышающую пунктирную линию.
• Чтобы провести замер в ёмкости, внутри которой табло EC-метра становится недоступно для считывания (например, в непрозрачной банке с узким горлом), в процессе замера нажмите кнопку HOLD (зафиксировать значение).
• Готово! Значение на табло обозначает концентрацию солей в вашем растворе. У TDS-метра оно отображается в ppm, у EC-метра — в миллисименсах на сантиметр (mS/cm) или микросименсах на сантиметр (uS/cm), в зависимости от модели.
Eau (eu) de parfum: что это такое значит

Это парфюмированная вода, которая также считается одним из самых популярных и востребованных продуктов. Стоит она несколько дороже, чем предыдущая, но и устойчивость ее дольше – в среднем, 5 часов. Большое количество покупателей отдают предпочтение именно такому продукту, так как это идеальное соотношение цены и качества. Современные производители предлагают нам огромный выбор подобных изделий. Многие виды очень схожи с настоящими дорогими брендами. В качестве примера часто приводится парфюм Coco Chanel №5 – вы заплатите одинаковую сумму за маленький флакон 7,5 мл и парфюмированную жидкость с таким же благоуханием и объемом в 100 миллилитров.
Концентрация парфюмерной воды Eau de Parfum (EDP) означает, что в ней наличествуют 10-12% аромавеществ и до 90% спирта.
Получение объема раствора с молярной концентрацией эквивалента
Задача 188.
Какой объём раствора с молярной концентрацией эквивалента 2 моль/л можно получить из 0,6 кг раствора кальций нитрата с массовой долей соли 3,4% (р = 1,01 г/мл)?Дано:
w% = 3,4% или 0,034;
m(p-pa) = 0,6 кг или 600 г;
МЭ[Ca(NO3)2] = 82,044 г/моль;
CЭ[Ca(NO3)2] = 2 моль/л;
V(p-pa) = ?Решение:Эквивалент – это условная или реальная частица, которая в данной химической реакции эквивалентна одному атому или иону водорода, или одному протону, или одному электрону (по — другому, способна замещать или присоединять 1 грамм водорода).Эквивалент – есть 1/z часть частицы (молекулы, атома).
У соли Z равно произведению валентности (степени окисления) металла на число атомов металла. Например,
Z[Ca(NO3)2] = (+2) · 1 = 2.
Z для (Al2(SO4)3) = 3·2 = 6.
Так как М[Ca(NO3)2] = 164,088 г/моль, то молярная масса эквивалента нитрата кальция равна молярной массе соли поделенной на влентность кильция, получим:
МЭ[Ca(NO3)2] = 164,088/2 = 82,044 г/моль.
Молярная концентрация эквивалентов вещества B CЭ(B) (нормальность – устаревшее) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль/л:
CЭ(B) = m(В)/[МЭ(B) • V(p-pa), где
MЭ – молярная масса эквивалента, m(В) — масса вещества в растворе, V(p-pa) — объем раствора вещества.
Отсюда
CЭ[Ca(NO3)2] = m[Ca(NO3)2]/{МЭ[Ca(NO3)2] • V(p-pa).
Закон эквивалентов для индивидуальных веществ, например для раствора Ca(NO3)2 записывается так:
m(B)/МЭ(В) = [CЭ(B) • V(p-pa)] или m[Ca(NO3)2]/МЭ[Ca(NO3)2] = {[Ca(NO3)2] • V(p-pa).
Отсюда
V(p-pa) = m(B)/[МЭ(В) • CЭ(B)] = m[Ca(NO3)2]/{МЭ[Ca(NO3)2] • CЭ[Ca(NO3)2]}.
Для решения задачи необходимо найти массу нитрата кальция в растворе, получим:
m[Ca(NO3)2] = w% • m(p-pa) = 0,034 • 600 = 20,4 г.
Тогда
V(p-pa) = m(B)/[МЭ(В) • CЭ(B)] = m[Ca(NO3)2]/{МЭ[Ca(NO3)2] • CЭ[Ca(NO3)2]} = 20,4 г/82,044 г/моль • 2 моль/л = 0,124 л или 124 мл.
Ответ: 124 мл.
Решение задачи можно представить так:
m[Ca(NO3)2] = w% • m(p-pa) = 0,034 • (600 • 1,01) = 20,604 г.
Тогда
V(p-pa) = m(B)/[МЭ(В) • CЭ(B)] = m[Ca(NO3)2]/{МЭ[Ca(NO3)2] • CЭ[Ca(NO3)2]} = 20,604 г/82,044 г/моль • 2 моль/л = 0,1256 л или 125,6 мл.
Ответ: 125,6 мл.
На заметку
• Поскольку со временем электроды прибора начинают покрываться слоем соли, которая снижает точность измерения, периодически протирайте их ватной палочкой, смоченной в уксусе или в спирте, после чего прополощите их в чистой воде и закройте колпачком.
• Если при погружении в дистиллированную воду ваш EC- или TDS-метр показывает значение больше нуля, вполне возможно, что он неточно настроен. Однако даже такой простенький прибор, как на фото, можно откалибровать вручную. Для этого, не вынимая прибор из дистиллированной воды, аккуратно подкрутите винтик потенциометра с обратной стороны устройства с помощью тонкой отвёртки, которая обычно прилагается в комплекте с прибором — до тех пор, пока цифры на табло не снизятся до минимально возможного положительного значения (к примеру, 3 ppm).
…Все очерки раздела «Заметки балконного выращивателя»
Понравилась эта статья? Поделитесь ей в соцсетях:
Растворы. Способы выражения концентрации
Истинными
растворами называются гомогенные системы, состоящие из двух или
большего числа компонентов, состав которых может непрерывно
меняться в определенных пределах.
Агрегатное состояние растворов может быть твердым, жидким или
газообразным. Обычно термин “растворы” относят к жидким
системам. Компонент раствора, имеющий то же агрегатное
состояние, что и раствор, называют растворителем, остальные
компоненты – растворенными веществами. Это деление достаточно
условно, например в растворе, компонентами которого являются
азотная кислота и вода, растворителем и растворенным веществом
можно считать каждый из компонентов. Подобные растворы называют
взаимными, например взаимный раствор азотной кислоты и воды.
Однако в случае, когда одним из компонентов раствора является
вода, ее традиционно считают растворителем.
Содержание растворенного вещества в растворе
может быть выражено несколькими способами:
Массовая доля растворенного вещества:
отношение массы растворенного вещества к массе раствора:
где – массовая доля
растворенного вещества, – масса
растворенного вещества, – масса
раствора. Это частный случай определения массовой доли.
Концентрация (молярная концентрация,
молярность): отношение количества растворенного вещества
к объему раствора V:
Молярная концентрация имеет принятую в химии размерность
[моль/л], которая часто обозначается М и называется молярностью.
Например, концентрация раствора 5 моль/л может быть записана как
5 М и такой раствор называется пятимолярным.
Эквивалентная (нормальная)
концентрация: отношение количества эквивалентов
растворенного вещества ЭКВ к
объему V раствора:
Эквивалент – это реальная или
условная частица вещества, которая в данной кислотно-основной
реакции эквивалента (равна) одному иону водорода или в данной
окислительно-восстановительной реакции – одному электрону.
Например в реакции
H2SO4 = K2SO4 +
2H2O
эквивалентом
гидроксида калия будет молекула КОН, а серной кислоты молекулы H2SO4.
Фактор эквивалентности
fЭКВ показывает, какая доля реальной частицы
данного вещества в данной кислотно-основной реакции эквивалента
(равна) одному иону водорода или в данной
окислительно-восстановительной реакции – одному электрону.
Для приведенного примера
1
1/2
Величина, обратная фактору
эквивалентности, называется эквивалентным числом
zB:
Число частиц эквивалентов вещества
NЭ связано с числом реальных частиц N
соотношением:
Количество вещества эквивалента
равно отношению числа частиц эквивалентов к числу Авогадро:
Молярная масса эквивалента равна отношению массы вещества к
количеству вещества эквивалента:
и имеет
размерность г/моль.
Эквивалентная
концентрация имеет размерность [моль эквивалента/л] и называется
также нормальной концентрацией или нормальностью раствора и
обозначается н. Например, раствор с эквивалентной
концентрацией 0,5 моль-эквивалентов/л называется полунормальным,
его концентрация запишется 0,5 н.
Молярная концентрация и массовая доля
растворенного вещества связаны между собой. Предположим, что мы
знаем массовую долю растворенного вещества , плотность раствора и молярную массу растворенного вещества М. В качестве
вспомогательной величины возьмем объем раствора V. Тогда масса
раствора :
масса
растворенного вешества:
количество растворенного
вещества:
Подставляем выражение для количества
растворенного вещества в формулу для концентрации и сокращаем
объем раствора V:
Если из полученного соотношения
выразить массовую долю растворенного вещества, то:
Оба выражения (для концентрации и массовой доли) содержат
размерные величины, поэтому подстановка числовых значений
требует от них определенных размерностей: С[моль/л], М[г/моль],
[г/л]. Для перевода плотности из
размерности [г/мл] необходимо числовое значение умножить на
1000:
[г/л] = [г/мл]•1000
Почему EC практичнее, чем TDS/ppm?
EC практичнее потому, что это стандартизированный физический показатель, который во всём мире понимается одинаково. Именно поэтому, получив рекомендацию довести ваш раствор до EC 1,2, вы чётко понимаете, что имеется в виду показатель 1,2 mS/cm (миллисименс на сантиметр).
А вот при использовании TDS-метра не всё так однозначно, поскольку данный прибор использует другую единицу измерения — ppm (англ. parts per million, «долей на миллион»). И, в зависимости от того, где и для кого данный прибор был изготовлен, для конвертации из EC в ppm он может использовать один из трёх стандартов:
- Американский стандарт, продвигаемый производителями измерительного оборудования Hanna Instruments и Milwaukee, для конвертации из EC в TDS в качестве эталона использует раствор поваренной соли (NaCl). Cогласно этому стандарту:
1 EC = 500 ppm
- Европейский стандарт, продвигаемый фирмой-производителем Eutech, для конвертации из EC в TDS в качестве эталона использует раствор хлорида калия (KCl). Согласно этому стандарту:
1 EC = 640 ppm
- Австралийский стандарт, продвигаемый новозеладской фирмой-производителем Bluelab, для конвертации из EC в TDS в качестве эталона использует среднюю электрокондуктивность раствора трёх солей, присутствующих в питьевой воде (сульфат натрия, бикарбонат натрия, хлорид натрия), взятых в пропорции 40/40/20. Поэтому согласно этому стандарту:
1 EC = 700 ppm
Итак, если вы измеряете в EC, то полученные значения будут понятны кому угодно без дополнительных уточнений. А если вы пользуетесь TDS, то, читая прикладную литературу или обмениваясь на форуме данными, полученными с помощью TDS-метра, вам придётся каждый раз уточнять, о каком из трёх стандартов ppm идёт речь, что непродуктивно и утомительно.
Состав парфюмерии
Любой парфюмерный продукт имеет определенный состав, главным компонентом которого является «действующее вещество». От его количества в основном зависит стойкость духов. Такими элементами могут быть компоненты растительного или животного происхождения. Разница заключается не только в способах их добычи, но и в крепости и устойчивости: последние сильнее и более сильными.
Растительные – добываются из лепестков цветов, кореньев, коры. Несмотря на то что они немного слабее, применяются чаще, чем животные продукты из гуманных соображений. Самыми популярными представителями флоры, использующимися парфюмерами, являются:
- сандал;
- роза;
- апельсиновые, персиковые, ирисовые цветы;
- цитрусовые;
- пачули;
- ветивер.
Отдельно стоит выделить жасминовые ноты, так как этот цветок является источником одного очень необычного элемента – индола. Индольность в парфюмерии – это тонкие сладкие нотки, пробуждающие в человеке животные инстинкты. Именно такие аккорды добавляют, чтобы придать аромату ауру соблазна и сексуальности. Хотя нужно отметить, что индол настолько привлекателен лишь в обработанном и в разбавленном состоянии. Сам по себе он имеет очень специфический, напоминающий отходы запах.
Элементы животного происхождения крайне дорогие. Их используют для закрепления и стойкости парфюмерной композиции. Но многие из них запрещено добывать, поэтому их парфюмеры заменяют синтетикой.
Среди подобных компонентов очень популярными являются:
- Амбра – наиболее дорогой ингредиент, который добывают из кишечника кашалота. Сегодня его добыча посредством отлова этих млекопитающих запрещена. Однако в парфюмерии могут использоваться фрагменты, выброшенные морем на берег.
- Мускус – без обработки имеет довольно специфический аммиачный запах. Но после спиртовой переработки он приобретает яркую чувственную, ни с чем не сравнимую ноту, способную украсить любой аромат. Он выделяется железами семейства косуль – кабарги. Еще совсем недавно, чтобы заполучить этот компонент, зверей приходилось убивать. Их поголовье начало значительно уменьшаться стремительными темпами. Поэтому был введен строгий запрет на их отлов и истребление. Мускус научились добывать более гуманным способом. В последнее время парфюмерами все чаще применяются синтетические схожие ингредиенты вместо природного.
- Кастореум – считается одним из наиболее ценных элементов, использующихся при создании парфюмерного продукта. Вещество выделяется железами бобра (его еще называют «бобровая струя»). Звучит, конечно, непривлекательно, однако это лучший фиксатор ароматической композиции.
Также в состав парфюма добавляют спирт, эфирные масла, растворитель, краситель. Специалисты могут применять синтетические добавки, чтобы заменить сложные натуральные компоненты. Такой материал изготавливают в специальных лабораториях.
Таблица ниже демонстрирует концентрацию ароматических веществ в духах, маркировку парфюмерии и спиртовые содержания в туалетной воде.
|
Наименование |
Душистые аромавещества |
Маркирование |
Насыщенность спирта |
|
Одеколон |
В Европе – 3-5% В США – 12-15% |
EDC |
70% |
|
Туалетная вода |
4-10% |
EDT |
85% |
|
Парфюмерная вода |
10-20% |
EDP |
90% |
|
Духи |
25-30% |
PARF |
90% |
Формула любой из описанных разновидностей расписывается в форме треугольника, который принято называть ольфакторной пирамидой. Композиция строится на 3 нотах: начальной, средней (сердце) и базисной. Первые проявляются и полностью начинают ощущаться уже через 15 минут после нанесения парфюма. Затем начинают играть сердечные нотки. Финальным аккордом является база, которая, как правило, обеспечивает силу, стойкость и шлейф.
Вычисление массовой доли спиртов в смеси этанола и метанола
Задача 189.
Для окисления смеси этанола и метанола в кислой среде потребовалось добавить 0,64 моль перманганата калия и при этом выделилось 8,96 л. газа. Вычислите массовые доли спиртов в исходной смеси.Решение:
1. Процессы окисления спиртов протекают по-разному:
5С₂H₅OH + 4KMnO₄ + 6H₂SO₄ = 5CH₃COOH + 4MnSO₄ + 2K2SO4 + 11H₂O5СH₃OH + 6KMnO₄ + 9H₂SO₄ = 5CО₂ + 6MnSO₄ + 3K₂SO4 + 19H₂O
2. Определим количество вещества СО2, образовавшегося при окислении метанола, получим:
n(СО2) = V(СО2)/Vm(СО2) = 8,96 л/22,4 л/моль = 0,4 моль.n(СH₃OH) = n(СО2) = 0,4 моль.m(СH₃OH) = 32 г/моль • 0,4 = 12,8 г.
3. Определим количество вещества KMnO₄, затраченное на окисление метанола получим:
n1(KMnO4) = 6/5n(СО2) = 1,2•0,4 = 0,48 моль.
4. Определим количество вещества KMnO₄, затраченное на окисление этанола получим:
n2(KMnO4) = n(KMnO4) — n1(KMnO4) = 0,64 — 0,48 = 0,16 моль.
Тогда
n(С₂H₅OH) = 5/4n(KMnO4) = 1,25 • 0,16 = 0,2 моль.
m(С₂H₅OH) = 46 г/моль • 0,2 = 9,2 г.
Отсюда
m(смеси) = 12,8 + 9,2 = + 22 г.
5. Вычислим массовые доли веществ, получим:
w%(СH₃OH) = /m(смеси) = (9,2 • 100%)/22 = 41,82%.
w%(С₂H₅OH) = 100% — 41,82 = 58,18%.
Ответ: w%(СH₃OH) = 41,82% • w%(С₂H₅OH) = 58,18%.
Определение объемных долей метана и этана в смеси газов
Задача 190.На сжигание природного газа объемом 200 л, содержащего метан, этан и негорючие примеси, затратили кислород объемом 395 л. Объемы газов измерены при нормальных условиях. Определите объемные доли метана и этана в газе, если объемная доля негорючих примесей составляет 5%.Решение:
1. Расчет объемов метана и этана в горючей смеси
Уравнения реакции горения веществ будут иметь вид:
1) CH4 + 2O2 = CO2 + 2H2O2) C2H6 + 3,5O2 = 2CO2 + 3H2O
Рассчитаем обем чистой газовой смеси, получим:
V(смеси) — 200 • (1 -0,05) = 190 л.
Из уравнений горения газов вытекает, что на сгорание 1 моль метана затрачивается 2 моль кислорода, а на сгорание этана — 3,5 моль.
Примем объм метана и этана в газовой смеси за «х» и «у» соответственно, 2х и 3,5Y.
Для вычисления состава смеси метана и этана в обьемных частях составим уравнение с двумя паременными, плоучим:
х + y = 190х + 3,5у = 395
Решим систему линейных уравнений методом подстановки:
Выразим из первого уравнения х + у = 190 данной системы «y» через «x», получим:
у = (190 — х).
Подставив во второе уравнение х + 3,5у = 395 данной системы вместо «y» выражение (19 — х), получим систему:
х + у = 190х + 3,5(190 — х) = 395
Полученные системы равносильны. В последней системе второе уравнение содержит только одну переменную. Решим это уравнение, получим:
х + 3,5(190 — х) = 395х + 665 — 3,5х = 395″х» = 108
Тогда
«у» = 190 — «х» = 190 — 108 = 82.
V(CH4) = 108 л;
V(C2H6) = 82 л.
2. Расчет объемных долей метана и этана в газе
w%V(CH4) = [V(CH4) • 100%]/V(смеси) = (108 л • 100%)/190 л = 56,84%;w%V(C2H6) = [V(C2H6) • 100%]/V(смеси) = (82 л • 100%)/190 л = 43,16%.
Ответ: w%V(CH4) = 56,84%; w%V(C2H6) = 43,16% л.